Veronica Kohn und Julia Roider, München*
 Act Now. Protect Our Present. Secure Our Future
Act Now. Protect Our Present. Secure Our Future
Antimikrobielle Resistenzen sind eine zunehmende Gefahr für die Weltgesundheit. Darauf hat die World AMR Awarness Week von 18.-24. November 2025 aufmerksam gemacht. Forscher der Universität Washington gehen davon aus, dass bis zum Jahr 2050 über 39 Millionen Menschen weltweit an Infektionen mit Antibiotika-resistenten Bakterien sterben werden.1 WHO-Experten warnen schon länger, dass der Einsatz von Antibiotika restriktiv gehandhabt werden sollte, um die Resistenz-Situation einzudämmen. In diesem Zusammenhang veröffentlichte die WHO im Jahr 2023 die aktuelle Auflage ihres AWaRe-antibiotic books 20222, in dem sie Maßnahmen zur Eindämmung der Resistenzentwicklung beschreibt. „AWaRe“ steht als Abkürzung für Gruppen von Antibiotika, die in einem Ampel-System von der WHO wie folgt klassifiziert werden:
Access-Antibiotika erfassen ein schmales Keimspektrum, haben ein gutes Nebenwirkungs-Profil und ein niedriges Potential zur Resistenzentwicklung. Sie werden als kalkulierte Erst- oder Zweitwahl-Therapie-Optionen empfohlen. Klassische Beispiele sind Penicilline wie Amoxicillin oder Ampicillin mit oder ohne Beta-Laktamase-Inhibitor (BLI).
Watch-Antibiotika sind speziellen Indikationen vorbehalten. Sie decken ein breiteres Keimspektrum ab und gelten als erste Wahl für Patienten mit schweren Infektionen oder wenn eine Resistenz gegen Access-Antibiotika zu erwarten ist. Dieser Gruppe sind zum Beispiel die Fluorchinolone und Cephalosporine der 2. und 3. Generation zugeordnet, die aufgrund ihres hohen Selektionsdruckes nur noch in der gezielten Therapie, aber nicht mehr in der kalkulierten Therapie einen Stellenwert haben sollten.
Reserve-Antibiotika sind nur als letzte Therapie-Option zur Behandlung multiresistenter Erreger im Einsatz und unterliegen daher in den Kliniken meist gesonderten Freigabe-Regelungen (Tab. 1).
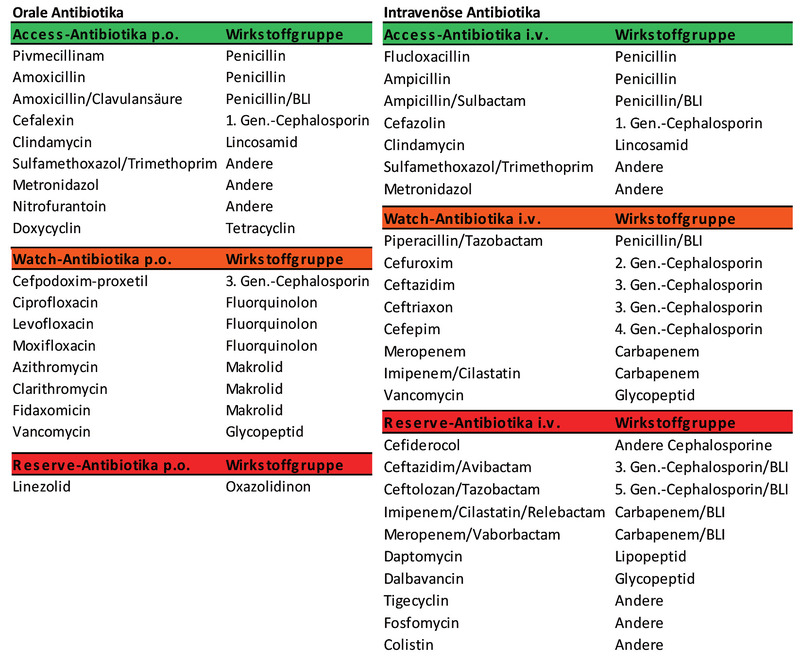
Tab. 1 Häufige Antibiotika nach AWaRe
Mit diesem Ampelsystem soll der verantwortungsvolle Umgang mit Antibiotika gefördert und inadäquate Verordnungen reduziert werden, um dadurch die Bildung von Resistenzen zu verlangsamen. Um das zu erreichen, wurde für das Jahr 2023 von der WHO das Ziel vorgegeben, dass mindestens 60% der global verbrauchten Antibiotika zur Access-Gruppe gehören sollten.
AWaRe in Deutschland
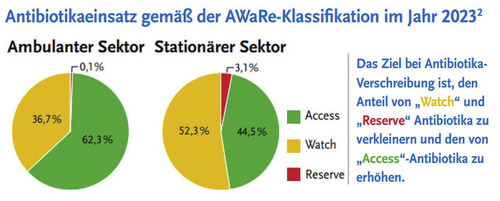
Abb. 1 Entnommen Website RKI3
In Auswertungen für Deutschland ermittelte das Robert Koch-Institut (RKI) über das Antibiotika-Verbrauchs-Surveillance-System, kurz AVS-System, den Antibiotika-Verbrauch, auch gemäß der AWaRe-Klassifikation. Im Jahr 2023 wurde im ambulanten Sektor das Ziel der WHO mit einem Anteil von 62,3% Access-Antibiotika erreicht. Im stationären Sektor lag der Anteil von Access-Antibiotika nur bei 44,5% (Abb. 1).3,4
Die Reduktion des inadäquaten Einsatzes von Watch-Antibiotika bezeichnet die WHO als Schlüssel zur Kontrolle der antimikrobiellen Resistenzentwicklung. Hierfür muss diese weltweit geltende Klassifikation zunächst in nationale und regionale Leitlinien Eingang finden und die „AWaRe-ness“ der Ärzteschaft erhöht werden.
Verbrauchs-Surveillance
Grundlage hierfür ist zunächst die Erfassung und Analyse des Antibiotika-Verbrauchs im eigenen Krankenhaus oder der Praxis. Diese Erfassung ist für Krankenhäuser bereits seit 2011 verpflichtend. Eine Teilnahme an einem nicht-kommerziellen Surveillance-System wie dem bereits genannten AVS-System des RKI ist hierfür sinnvoll. Dies war bislang freiwillig. Laut einem GBA-Beschluss ist die Teilnahme für Krankenhäuser, die Reserve-Antibiotika verordnen, diesbezüglich seit 01.01.2024 verpflichtend. Eine quartalsweise Rückmeldung wäre sowohl im ambulanten als auch im stationären Bereich ein wesentlicher Baustein um die Verordnungspraxis nachhaltig zu verändern. In vielen Krankenhäusern übernimmt die Aufgabe die Verbrauchszahlen zu analysieren und in den Fachabteilungen zu kommunizieren das sogenannte Antibiotic-Stewardship-(ABS-), auch genannt Antimicrobial-Stewardship-(AMS)-Team. Doch auch dieses steht nicht in allen Kliniken zur Verfügung. Im ambulanten Bereich gibt es hierzu keine Entsprechung. Jedoch stehen mittlerweile nach erfolgreichem Abschluss des Projektes SAMBA (Surveillance ambulanter Antibiotika--Verbrauch) des RKI auch in der ambulanten Versorgung teilweise arztindividuelle Berichte für ausgewählte Fachgruppen zur Verfügung. Die angemeldete S3-Leitlinie zu diesem Thema (Antibiotic Stewardship ambulant) verdeutlicht die Relevanz, da der überwiegende Anteil der Antibiotika-Verordnungen im ambulanten Bereich erfolgt. Diese soll 2027 fertiggestellt werden.
Verbrauch in Deutschland
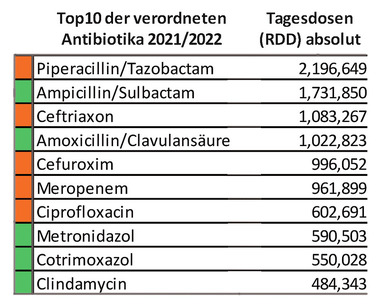
Tab. 2 Top 10 Wirkstoffe in Deutschland (entnommen aus 5)
Tabelle
2 listet die Top 10 der verordneten Antibiotika 2021/22 in den 329
Teilnehmerkliniken einer Studie zur Antibiotika-Anwendung in
deutschen Akutkrankenhäusern auf. An erster Stelle waren
Penicillin/beta-Laktamase-Inhibitoren, gefolgt von 2./3.
Generations-Cephalosporinen (Ceftriaxon und Cefuroxim). Diese Studie
lief über 10 Jahre von 2012/13 bis 2021/22. In diesem Zeitraum
zeigte sich eine gleichbleibende Verbrauchsdichte.
Allerdings
gab es Verschiebungen in den Substanzklassen. Die angestrebte
Restriktion von Cephalosporinen und von Fluorchinolonen (beides
Watch-Gruppe) war messbar und somit erfolgreich. Beide
Substanzgruppen wurden in diesem 10-Jahreszeitraum weniger eingesetzt
und stattdessen mehr Penicillin-Derivate verwendet. Eine erfreuliche
Entwicklung, die den Erfolg von ABS-Programmen zeigt.5
Eine Auswertung des Antibiotika-Verbrauchs in der stationären Pädiatrie zwischen 2013 und 2020 zeigte wiederum weiteren Handlungsbedarf. Im Jahr 2020 waren in diesem Bereich Cephalosporine die am häufigsten verschriebene Antibiotikaklasse. Antibiotika der Watch- und Reserve-Kategorien, darunter Breitspektrumpenicilline (+ 31%), Linezolid (+ 121%) und Glykopeptide (+ 43%), nahmen laut dieser Studie im Laufe der Zeit zu. Die Autoren schlussfolgern daher, dass u.a. die hohen Verschreibungsraten für Cephalosporine und ein vermehrter Einsatz von Reserve-Antibiotika auf eine verbesserungswürdige Qualität der Antibiotikaverschreibung hindeuten und ABS-Programme dieses Thema dringend priorisieren sollten.6
„Common infections“
Auch eine Reduktion des Gesamt-Antibiotikaverbrauches durch nicht-indizierte oder verlängerte Antibiotika-Therapien hat Einfluss auf das Erreichen des ausgeschriebenen WHO-Ziels. Deshalb sollten Infektionserkrankungen, die ohne Antibiotika behandelt werden können, als solche erkannt werden. Als Beispiele hierfür werden im AWaRe-antibiotic book 2022 milde Verläufe der häufigsten „common infections“ genannt. Hierzu zählen Bronchitis, COPD-Exazerbationen, Otitis media, Pharyngitis, Sinusitis, Zahninfektionen, Haut- und Weichgewebe-Infektionen, untere Harnwegsinfektionen und infektiöse Durchfallerkrankungen. Zudem weist die WHO explizit daraufhin, dass wenn Antibiotika erforderlich sind, 9 der 10 häufigsten „common infections“ (das sind die o.g. und die ambulant erworbene Pneumonie) mit Access-Antibiotika behandelt werden können. Einzige Ausnahme hiervon stellt die akute Gastroenteritis einhergehend mit blutigen Durchfällen dar. Hier sind weiterhin Ciprofloxacin oder Azithromycin (beides Watch-Gruppe) erste Wahl. Zudem findet man im AWaRe-antibiotic book 2022 spezifische Empfehlungen zu einzelnen Infektionserkrankungen, Informationen zur Penicillin-Allergie und Dosierungstabellen.
Think D8 – before prescribing
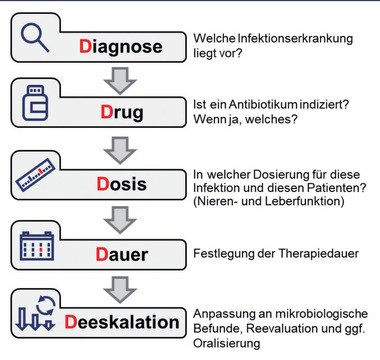
Abb. 2 Die 5 Ds
Die allgemeinen Empfehlungen der WHO für die Verordnung von Antibiotika stehen unter dem Slogan „Think D8 – before prescribing“. Diese 8Ds betreffen die Entscheidung (Decision) ob überhaupt Antibiotika notwendig sind, die Diagnose, die Auswahl des richtigen Antibiotikums (Drug) in der richtigen Dosis, die Verabreichungsform (Delivery), die Dauer, die Diskussion mit den Patienten und die Dokumentation. Im klinischen Alltag in Deutschland hat eine gekürzte Form Eingang in die Praxis gefunden. Dies sind die 5Ds: Diagnose, Dosis, Dose, Dauer und Deeskalation. Diese sind die Grundlage für eine korrekte Antibiotika-Verordnung, nicht nur von zum Beispiel Harnwegsinfektionen oder schweren nosokomialen Pneumonien7,8, sondern im Allgemeinen bei jeder Verordnung einer antibiotischen Therapie. Hervorzuheben ist die Erinnerung an die Deeskalation in diesem Schema als 5. D (Abb. 2), welche auch eine Fokussierung bei Erregernachweis und die Evaluation einer möglichen Oralisierung oder Beendigung der Therapie beinhaltet.
Mit der AWaRe-Klassifikation, den Empfehlungen zu den „common infections“ und den Empfehlungen zu den Ds der korrekten Antibiotika-Verordnung zeigt uns die WHO somit mehrere Werkzeuge auf, um der Ausbreitung von Resistenzen zu begegnen.
* für die Sektion Antimicrobial Stewardship der Deutschen Gesellschaft für Infektiologie
1 Global burden of bacterial antimicrobial resistance 1990-2021: a systematic analysis with forecasts to 2050. Lancet, 2024. 404(10459): p. 1199-1226.
2 WHO, The WHO AWaRe (Access, Watch, Reserve) antibiotic book. 2022: © World Health Organization 2022.
3 RKI, Antibiotikaverbrauch im ambulanten und stationären Sektor in Deutschland. https://amr.rki.de/Docs/AMR_Infografik_Antibiotikaverbrauch.pdf, 2024.
4 Aghdassi, S.J.S., et al., Healthcare-Associated Infections and the Use of Antibiotics in German Hospitals-Results of the Point Prevalence Survey of 2022 and Comparison With Earlier Findings. Dtsch Arztebl Int, 2024. 121(9): p. 277-283.
5 Kern, W.V., et al., [Antibiotic prescribing trends in German acute care hospitals from 2012/13 through 2021/22]. Dtsch Med Wochenschr, 2025. 150(3): p. e1-e10.
6 Freudenhammer, M., et al., Antibiotic use in pediatric acute care hospitals: an analysis of antibiotic consumption data from Germany, 2013-2020. Infection, 2024. 52(3): p. 825-837.
7 Goebel, M.C., B.W. Trautner, and L. Grigoryan, The Five Ds of Outpatient Antibiotic Stewardship for Urinary Tract Infections. Clin Microbiol Rev, 2021. 34(4): p. e0000320.
8 Morency-Potvin, P., D.N. Schwartz, and R.A. Weinstein, Antimicrobial Stewardship: How the Microbiology Laboratory Can Right the Ship. Clin Microbiol Rev, 2017. 30(1): p. 381-407.








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen