Christoph Boesecke und Jürgen Rockstroh, Bonn
Antiretrovirale Therapie 2026 and more
Die antiretrovirale Therapie ist eine Erfolgsgeschichte. Die Entwicklung ging im Vergleich zu anderen Therapien atemberaubend schnell. Die Meilensteine im Überblick: 1985 die erste Substanz Zidovudin, 1995 der erste Proteasehemmer, 1996 das erste Regime mit einem Proteasehemmer +2 NRTI, 1996 der erste NNRTI, 2006 das erste STR, 2007 der erste INSTI, 2014 der erste INSTI der zweiten Generation, 2019 das erste duale STR Regime 2020 das erste langwirksame Regime.
Maximum erreicht?
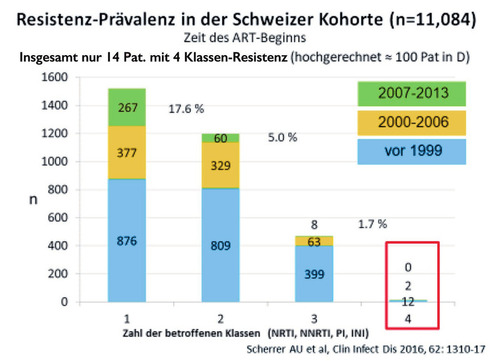
Abb. 1 Zahl der Patient*innen, die in Deutschland auf Grund von Mehrklassenresistenzen dringend auf neue Substanzen angewiesen sind, hat stetig abgenommen und liegt <1%
Im Hinblick auf die virologische Wirksamkeit der ART ist das Maximum erreicht. In den Phase-3-Zulassungsstudien zu oralen Integrasehemmern der zweiten Generation kam es nur noch extrem selten zum virologischen Versagen und selbst dann waren keine Resistenzen nachweisbar. Auch im Hinblick auf die Verträglichkeit hängt die Latte sehr hoch. In den genannten Studien brachen weniger als 1% der Teilnehmenden die ART wegen Nebenwirkungen ab. Selbst der Bedarf an neuen Substanzen ist gering. Weniger als 1% der Menschen mit HIV in Deutschland haben eine Mehrklassen-Resistenz, die sich mit den aktuell verfügbaren Substanzen nicht kontrollieren lässt (Abb. 1). Brauchen wir also überhaupt noch neue Medikamente zur Therapie der HIV-Infektion? Diese Frage ist mit ja zu beantworten. Angesichts der zunehmenden Resistenz gegen Integrasehemmer in Afrika und dem (in Zukunft) zunehmenden Einsatz von langwirksamen PrEP-Optionen werden neue Therapieoptionen sicherlich gebraucht.
Wunschliste
Fragt man Menschen mit HIV, was sie sich im Hinblick auf ihre HIV-Medikation wünschen, steht eine langwirksame ART ganz oben auf der Liste. Der Grund dafür ist – einer Befragung in Europa zufolge – das mit HIV verbundene Stigma. Nicht mehr täglich an die Erkrankung denken zu müssen, keine „verräterischen“ Tabletten im Haus, das ist für Menschen mit HIV wichtig. Das Dosierungsintervall sollte dabei möglichst lange sein und die Applikation schmerzfrei. Wichtig sind zudem die „Forgiveness“ bei Terminverzögerungen, die Notwendigkeit von Kontrolluntersuchungen und der Ort der Applikation (Abb. 2).
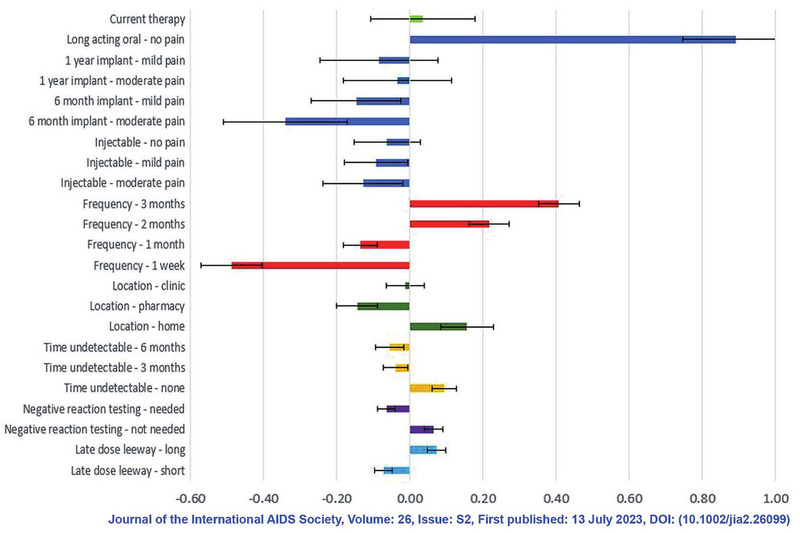
Abb. 2
Patientenwünsche für langwirksame Regime. Befragung von 700 Personen in Seattle und Atlanta
Einmal tägliche ART
Aktuell in der Entwicklung sind nicht nur langwirksame ART-Regime, sondern auch neue orale tägliche Fixkombination: Die neue INSTI-freie Kombination mit dem NRTTI Islatravir und dem NRTI Doravirin sowie das duale Regime mit dem INSTI Bictegravir und dem Kapsidinhibitor Lenacapavir. In einer aktuellen Switch-Studie bei supprimierten Patienten, die auf der CROI 2025 vorgestellt wurde, war Islatravir 0,25 mg/Doravirin 100 mg einmal täglich Bictegravir/F/TAF virologisch und im Hinblick auf die Verträglichkeit ebenbürtig (Abb. 3). Islatravir hatte in dieser Dosierung keinen negativen Einfluss auf die Lymphozytenzahl.
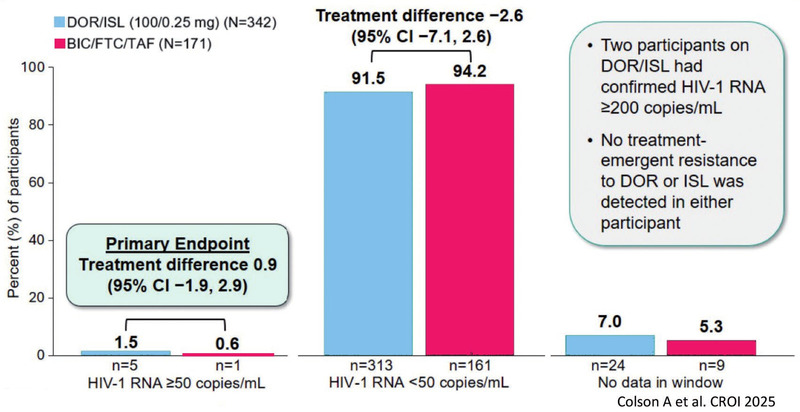
Abb. 3 Switch-Studie DOR/ISL vs BIC/F/TAF bei supprimierten Patienten
Die Kombination Bictegravir 75 mg/ Lenacapavir 25 oder 50 mg einmal täglich wurde ebenfalls in einer Switch Studie bei supprimierten Patienten geprüft, allerdings mit der Besonderheit, dass in einem Studienarm Teilnehmer von einem „komplexen Regime“ umgestellt wurden (Abb. 4). Auch hier war die virologische Wirksamkeit überzeugend (Abb. 5).
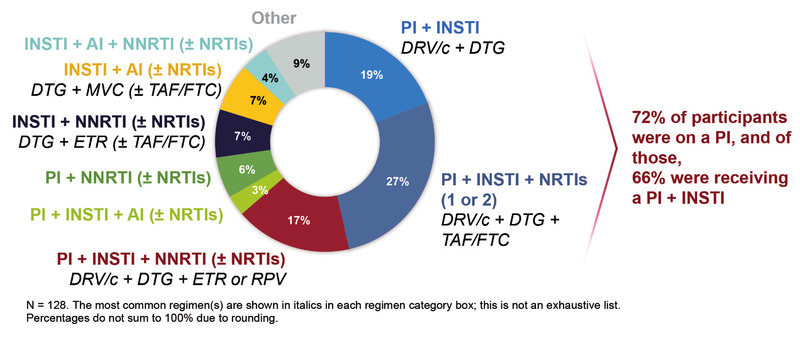
Abb. 4 Switch-Studie ARTISTRY-1 an supprimierten Patienten. Baseline-Regime, von denen die Teilnehmer*innen umgestellt wurden
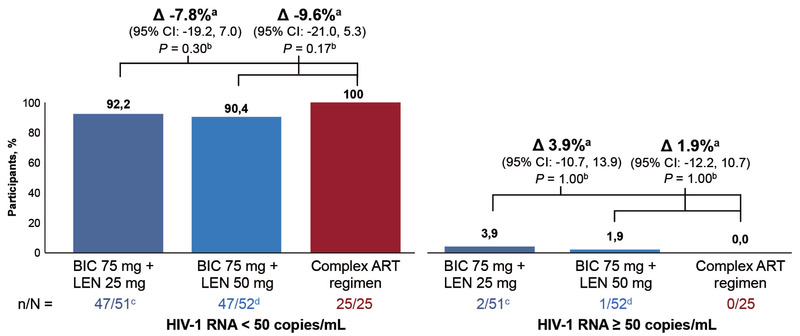
Abb. 5 ARTISTRY-1 Virologische Suppression zu Woche 48 (US FDA Snapshot)
Langwirksame ART
Hier sind verschiedene Konzepte in der Entwicklung: Einmal eine Tablette /Woche, intramuskuläre Injektionen alle 4-6 und 12 Monate sowie subkutan oder intramuskulär LA-ART plus intravenös breit neutralisierende Antikörper (bnABs). Zu einigen dieser Regime liegen bereits einige Phase-2-Studien vor.
Die orale einmal wöchentliche Kombination Islatravir 2 mg/Lenacapavir 300 mg hatte im Switch-Setting eine mit BIC/F/TAF vergleichbare virologische Wirkung und gute Verträglichkeit. Die ebenfalls einmal wöchentlich einzunehmende Tablette mit dem neuen NRTI Ulonivirin 200 mg/Islatravir 20 mg (diese hohe Islatravir-Dosierung wird in neueren Studien nicht mehr eingesetzt) zeigte als Firstline einen vielversprechenden virologischen Effekt.
Die Kombination von Cabotegravir und Lenacapavir ist ebenfalls eine Option, die zunächst in einer kleinen Pilot-Studie von der ACTG geprüft wird. Eine größere Studie ist geplant, die Realisierung könnte jedoch schwierig sein, da die Substanzen von zwei konkurrierenden Herstellern stammen und öffentliche Gelder in den USA derzeit knapp sind.
Bei den langwirksamen parenteralen Medikamenten scheint eine „ultralangwirksame“ neue Formulierung von Cabotegravir (ULA-CAB) ein Dosierungsintervall von 4 Monaten zu ermöglichen. Hier braucht man aber einen ebenfalls so lang wirksamen Partner. Versuche zu einer Verlängerung des Dosierungsintervalls von Rilpivirin und Lenacapavir auf 12 Monate sind derzeit im experimentellen Stadium.
Neue Substanzen
Auch neue Substanzen der bekannten Klassen sind in der Entwicklung. VH-184 ist ein Integrasehemmer der dritten Generation, der auch bei Dolutegravir-Resistenz wirksam ist. GS-1219 und GS 3242 sind Integrasehemmer, VH-184 und VH-499 neue Kapsidinhibitoren. Zu diesen Substanzen liegen bislang nur spärliche präklinische Daten vor.
Neue Strategien
Ein völlig neues Konzept mit einem Dosierungsintervall von sechs Monaten ist die Kombination eines antiretroviralen Medikamentes mit breit neutralisierenden Antikörpern (bnABs). Herausforderungen hier sind insbesondere primäre und sich unter Therapie entwickelnde Resistenzen gegen die Antikörper. Der Kapsidinhibitor Lenacapavir wurde deshalb gleich mit zwei bnABs kombiniert. In der Phase-2-Studie mit Lenacapavir und den bnABs Teropavimab (TAB) und Zinlirvimab (ZAB) einmal alle 6 Monate subkutan an supprimierten Patienten ohne Resistenz gegen die Antikörper, zeigte sich in den ersten 28 Wochen ein guter virologischer Effekt – und gleichzeitig auch das Problem dieser Therapie (Abb. 6a und b). Bei einem Teilnehmer wurde zu Woche 16 ein deutlicher Anstieg der Viruslast beobachtet. Zu Woche 26 wurde auf eine orale Integrasehemmer-haltige Standardtherapie gewechselt. Zu Woche 24 ließen sich Resistenzen gegenüber Lenacapavir (Q67H) sowie ein Wirkverlust von ZAB nachweisen (Abb. 6a und b).
Eine
Kombination eines langwirksamen INSTI mit bnABs ist ebenfalls eine
Option. Untersucht wird ULA-Cabotegravir in Kombination mit dem bnAB
N6LS alle vier Monate. Auch hier gab es bereits erste positive
Ergebnisse.

Abb. 6a Lenacapavir + bnABs Teropavimab (TAB) und Zinlirvimab (ZAB) Q6M vs Baseline-Regime weiter. Virologische Suppression zu Woche 26
Abb. 6b Verlauf Viruslast eines Patienten mit Resistenz-Entwicklung
Große Hürden
In Deutschland stehen prinzipiell alle neu eingeführten antiretroviralen Medikamente sofort zur Verfügung. Doch es gibt Einschränkungen. Die erste Einschränkung kam nach Ablauf des Patents von TDF, als der Hersteller den Preisvorschlag der „AMNOG Runde“ für die neue Tenofovir-Formulierung TAF (als STR mit FTC in Descovy®) nicht akzeptierte. Das Medikament wurde/wird nicht von der GKV erstattet. Die Folge war eine – vielleicht auch vom Hersteller gewünschte – Umstellung vieler Patienten auf ein STR des gleichen Unternehmens. In absehbarer Zeit wird das Patent für Dolutegravir, eine Kernsubstanz aktueller ART-Regime, ablaufen: 2028 in den USA und 2029 in Europa. In der Regel stehen generische Präparate ein Jahr später zur Verfügung. Als Vergleichsregime im AMNOG-Verfahren, das jedes neue Medikament in Deutschland zur Preisfindung durchlaufen muss, wird daher vermutlich generisches Dolutegravir und generisches TDF/FTC gewählt werden. Der Weg zum finanziellen Erfolg neuer Medikamente wird dadurch erheblich erschwert. Man kann nur hoffen, dass die Entwicklung neuer innovativer ART-Regime nicht so abgebremst wird wie bei den Antibiotika. Die Pharmaindustrie hat sich aus diesem Bereich fast komplett zurückgezogen. Innovationen muss man mit der Lupe suchen – zum Nachteil der Patienten.
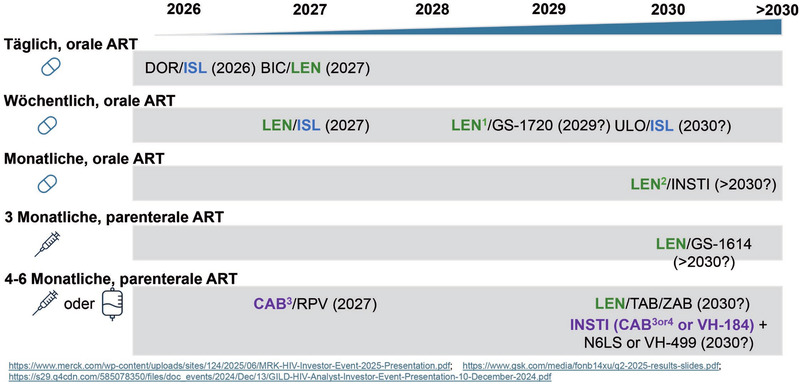
Abb. 7 Übersicht zu neuen Regimen in der Pipeline
Zusammenfassung
Es gibt viele spannende Entwicklungen am Horizont von neuen einmal täglichen STR bis hin zu sechsmonatigen parenteralen Regimen. Die zentralen Vorteile sind – nachdem bei virologischer Wirksamkeit und Verträglichkeit das Maximum erreicht ist – neuartige Kombinationen und längere Dosierungsintervalle. Die Preisgestaltung und damit auch der finanzielle Erfolg neuer Medikamente als Triebfeder der Entwicklung – wird sich nach dem Patentablauf von Dolutegravir möglicherweise schwierig gestalten.








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen