Christian Glück und Thomas Glück, Zürich und Trostberg
Wichtige Leitlinien-Updates 2024/2025
Jedes Jahr erscheinen etliche neue Leitlinien (LL) oder Updates früher publizierter Leitlinien, in welchen die aktuellen Erkenntnisse zu Diagnostik und Therapie von infektiologischen Problemen zusammengefasst werden. Ziel dieses Artikels ist es, die wesentlichen Aussagen der Leitlinien prägnant zusammenzufassen und kurz zu kommentieren. Details müssen jedoch jeweils in der Originalpublikation (siehe Literaturverzeichnis) nachgelesen werden.
Perioperative Antibiotika-prophylaxe1
Die Ende 2024 publizierte S3-LL zur perioperativen und periinterventionellen Antibiotikaprophylaxe (PAP) (AWMF 067-009)1 stellt ein Klassen-Upgrade zur veralteten S1-Leitlinie von 2012 dar. Die Fachverbände aller operativ tätigen Disziplinen waren an der Erstellung beteiligt.
Bestätigt wurden in der LL
- Die PAP ist für die allermeisten Eingriffe eine Einzeldosis, ca. 30 min vor dem Schnitt zu verabreichen (längere PAP wurde für offene Frakturen, für die Herzchirurgie (ohne sichere Evidenz) und die transrektale Prostatabiopsie angegeben). Werden Antibiotika mit kürzerer Halbwertszeit zur PAP gegeben, soll eine Wiederholungsdosis nach der doppelten HWZ erfolgen. Dies ist für das am häufigsten zur PAP eingesetzte Cefuroxim bereits nach ca. 2–3 Stunden der Fall.
- Cefuroxim (ggf. Cefazolin) ist für die meisten Situationen weiterhin das in erster Linie zur PAP empfohlene Antibiotikum, alternativ Ampicillin/Sulbactam.
Neu in der LL zur PAP ist
- Es werden zwar für Penicillin- bzw. Cefalosporin-Allergie jeweils alternative Antibiotika zur PAP vorgeschlagen, aber die LL enthält ausführliche Anweisung zum De-Labeling einer vermeintlichen Penicillin-Allergie, da die Alternativen zu den primär einzusetzenden Betalactam-Antibiotika mit Nachteilen versehen sind
- Bei komplexen Eingriffen am Pankreas (Whipple-OP) soll Piperacillin/Tazobactam zur PAP gegeben werden
- Eine Besiedelung mit multiresistenten Erregern ist in der PAP bei Relevanz, je nach OP-Region zu berücksichtigen (ESBL-produzierende Erreger bzw. MRGN, MRSA)
- Zusätzlich zur unmittelbar perioperativ verabreichten PAP soll bei kolorektaler Chirurgie 1-2 Tage vor der OP eine orale PAP gegeben werden
- Adipöse Patienten >120 kg sollten, mit >150 kg sollen von Cefuroxim, Cefazolin, Amoxicillin/Sulbactam oder (sofern indiziert) Metronidazol die doppelte Dosis erhalten
- Bei Schulter-Eingriffen (wegen Risiko für Infektionen mit Propionibacterium) und bei Interventionen mit transfemoralem Zugang (wegen Risiko für Enterokokken) soll Ampicillin-Sulbactam zur PAP gegeben werden
- Auch bei Blutverlust >1,5 Liter soll eine Wiederholungsdosis gegeben werden
- Das ABS-Team soll in Zusammenarbeit mit den jeweiligen Abteilungen die LL in der jeweiligen Klinik umsetzen und stichprobenartig überwachen
- Die Verantwortlichkeiten für die PAP sind in der LL klar empfohlen: Der Chirurg stellt die Indikation und gibt das Antibiotikum zur PAP vor, der Anästhesist setzt dies um.
Kommentar
Die S3-LL zur PAP leistet sicher einen bedeutenden Beitrag zur rationalen Gestaltung des Antibiotika-Einsatzes bei der PAP. Dennoch muss angemerkt werden, dass das Evidenz-Niveau für viele Aspekte relativ gering ist, und außer zur Wundinfektionsrate keine Untersuchungen zum Einsatz von Antibiotika zur PAP vorliegen, insbesondere nicht zum Auftreten von „Kollateral-Schäden“ der PAP.
Kultur-negative Endokarditis2
Bei Endokarditis ist die Kenntnis des Erregers essentiell für die Wahl der optimalen Behandlung. Gar nicht selten sind jedoch die Kulturen negativ, am häufigsten weil bereits eine Antibiotikatherapie begonnen worden war, bevor an die Abnahme von Blutkulturen gedacht wurde, und seltener bei Erregern, die gar nicht kulturell anzüchtbar sind. Die American Heart Association und die International Society for Cardiovascular Infectious Diseases haben für diese Situationen eine Leitlinie herausgegeben.
Die
wesentlichen Punkte sind ...
Diagnostik
- Vor Beginn einer Antibiotikatherapie, wenn der Fokus nicht offensichtlich ist (und damit eine Endokarditis in Frage kommt), IMMER 2 Paar Blutkulturen abnehmen, um die Situation einer „zufällig“ anbehandelten, Kultur-negativen Endokarditis zu vermeiden (bei V.a. Endokarditis prolongierte Bebrütung der Blutkulturen)
- Risikofaktoren des Patienten für eine Endokarditis durch nicht kultivierbare Erreger erfragen (Tierkontakt, Milchprodukte Coxiella burnetii; schlechte Hygiene bzw. Katzen-Kontakt Bartonellen; Reisen und dortige Ernährung (Milchprodukte!) Brucellose): länger anhaltende Allgemeinsymptome T. whipplei; vorangegangene (Herz-)OPs Mykobakterien (vermutlich unterdiagnostiziert!); i.v.-Drogenabusus, parenterale Ernährung, Neutropenie, schwere Immunsuppression Pilze)
- Wenn bei suffizienter Blutkultur-Diagnostik nach 72h kein Wachstum, dann Serologie auf Coxiella, Bartonellen, Brucellen, und T. whipplei-PCR aus Blut (bei T. whipplei auch aus Duodenal-Biopsien). DD nicht-bakterielle Endokarditis erwägen (Marasmus, SLE, Phospholipid-AK-Syndrom). Auf die Probleme der Serologien wird eingegangen
- Wenn keine adäquate Blutkultur-Diagnostik erfolgte: panbakterielle PCR aus Blut (z.B. Sepfast® o.ä.). Frühzeitige Abnahme im Verlauf, aber vorsichtige Interpretation! Infektiologe/klin. Mikrobiologe zuziehen!
- Falls Klappen-OP nötig, aus der entfernten Klappe: Kultur, Pathologie und pan-bakterielle bzw. pan-fungale PCR oder FISH.
Empirische Therapie
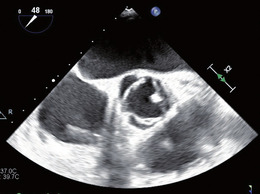
Abb. 1 Aortenklappe ohne flottierende Vege- tation. Unspezifische, rundliche Verdickung des Klappenrandes
Die Empfehlungen unterscheiden sich i.d. USA vs. Europa und Nativklappe vs. Kunstklappe (hier auch: früh vs. spät) und ob es sich um eine Kultur-negative Endokarditis ohne adäquate BK-Diagnostik ( dann meist Staphylokokken, Streptokokken, Enterokokken!) oder trotz adäquater BK-Diagnostik (dann atyp. Erreger wahrscheinlicher!) handelt:
- Nativklappe: Vancomycin + Ceftriaxon (USA) bzw. Ampicillin + Ceftriaxon (Europa)
- Kunstklappe
(<1Jahr): Vancomycin + Rifampicin + Gentamicin + Cefepim (USA)
bzw. Daptomycin od. Vancomycin + Rifampicin + Gentamicin (Europa)
Gentamicin wird von einigen Experten der LL kritisch gesehen bzw. vermieden wg. Nephro-/Oto-Toxizität - Modifikation zeitnah nach den Ergebnissen der zusätzlichen Diagnostik bzw. nach Verlauf bzw. nach Risikofaktoren (s.o.) des Patienten
Sepsis3
Die Fachgesellschaften mit Bezug zur Intensivmedizin haben am 30.04.2025 ein Update der S3-Leitlinie: Sepsis – Prävention, Diagnose, Therapie und Nachsorge (AWMF 079-0013) zur Version von 2018 herausgegeben. Die LL der Surviving Sepsis Campaign vom 4.10.2021 wurde als Referenz-LL herangezogen und mit aktueller Literatur ergänzt. Im Wesentlichen wird hier auf die infektiologischen Aspekte der LL eingegangen.
Screening
- Die LL empfiehlt, bei Patienten außerhalb von Intensivstationen, bei denen der V.a. Infektion besteht, ein Screeninginstrument (Score) anzuwenden und mit einem Qualitätssicherungsverfahren dies (wie auch die anderen Maßnahmen in der Sepsis-Therapie) zu überprüfen (Start QS-Verfahren „Diagnostik und Therapie der Sepsis“ am 1.1.2026). Die Bestimmung des Laktat soll bei V.a. Sepsis Teil des Screenings sein
- Bei V.a. Sepsis soll die Verabreichung von intravenösen Antiinfektiva so schnell wie möglich erfolgen:
- Bei Patienten mit einem septischen Schock innerhalb einer Stunde
- Bei Patienten ohne Schock (Katecholamin-Pflichtigkeit) soll zunächst eine zügige Diagnostik erfolgen, bei bestätigter Infektion i.v. Antibiotikagabe innerhalb von 3 h
- Wahl/Dauer der Antibiotikatherapie:
- Je nach Risiko des Patienten (nosokomial vs. ambulant erworben), ggf. bekannter Besiedelung mit resistenter Flora und Ort der Infektion
- Bei Patienten ohne Risiko für multiresistente gramnegative Erreger keine routinemäßige Gabe von 2 oder mehr verschiedenen Substanzen mit gramnegativer Wirksamkeit
- Beta-Laktam-Antibiotika sollen als prolongierte oder kontinuierliche Infusion gegeben werden
- Patienten mit Sepsis oder sept. Schock ohne Risiko für Pilzinfektion sollen keine empirische antimykotische Therapie erhalten. Bei Patienten mit Risikofaktoren (in der LL ausgeführt) kann dies erfolgen
- Fokussierung der Therapie bei plausiblem Erregernachweis so bald als möglich. Falls kein oder kein plausibler Erregernachweis gelingt, ist eine Therapie-Fokussierung bei gutem klinischen Ansprechen möglich
- Die
Dauer der Antibiotikatherapie soll in der Regel 7–10 Tage betragen,
nur bei nicht sanierbarem Fokus länger.
Procalcitonin soll im Verlauf bestimmt werden zur Verkürzung der Antibiotikadauer, es sei denn Infektionsort und Erreger bedingen eine definierte Therapiedauer (z.B. S. aureus-Bakteriämie) - Immunglobuline sollen nicht gegeben werden
- Unselektive Blutreinigungsverfahren (Cytosorb®, etc.) sollen nicht eingesetzt werden, zu Plasmapherese und Polymyxin B-Hämoperfusion macht die LL keine Empfehlung.
Weitere
Empfehlungen der deutschen Sepsis-LL 2025 betreffen
Kreislauf-management/Infusionstherapie, Beatmung, das Für und Wider
von externer Kreislaufunterstützung (ECMO) bei Sepsis,
Kortikosteroid-Gabe, Nierenersatztherapie,
Gerinnungsmanagement,
Antikoagulation,
Blutzucker-Einstellung, Stressulcus-Prophylaxe,
Vitamin-Gabe und Nachsorge, auf welche an dieser Stelle nicht
eingegangen werden soll.
 © Adobe Stock
© Adobe Stock
Diagnostik bei primärem Immundefekt4
Nicht selten werden Infektiologen mit der Frage nach einem Immundefekt bei Patienten mit gehäuften Infektionen involviert. Die Gesellschaft für pädiatrische Immunologie hat am 14.07.2025 ein Update der S3-LL zur Diagnostik bei V.a. Primären Immundefekt3 herausgegeben, welches über dieses komplexe Thema (es sind 555 molekular definierte primäre Immundefekte beschrieben) einen Überblick gibt und Leitsymptome herausstellt. Selbstverständlich müssen sekundäre Immundefekte (HIV-Infektion, immunsupprimierende Therapien, ggf. endokrine Störungen) zunächst abgegrenzt werden. Die Mehrzahl der primären Immundefekte manifestiert sich im Kindesalter, aber die Diagnose wird nicht selten erst im Erwachsenenalter gestellt (bis zu 50% der Neudiagnosen von primären Immundefekten betreffen Patienten älter als 25 Jahre).
Die wesentlichen Aussagen der LL zu primären Immundefekten sind:
 © KI Adobe Firefly
© KI Adobe Firefly
- Schlüssel-Symptome, die auf einen Immundefekt hinweisen, sind im Akronym ELVIS abgebildet:
- „E“ – ungewöhnliche Erreger (z.B. atyp. Mykobakterien, Pneumocystis)
- Eine Liste von Erregern, die für verschiedene primäre Immundefekte (relativ) charakteristisch sind, stellt die Leitlinie vor.
- „L“ – ungewöhnliche Lokalisation (z.B. Aspergillus-Hirnabszess)
- „V“ – protrahierter oder chronischer Verlauf (auch protrahierte Reaktionen auf Impfungen)
- „I“ – der Schweregrad (Intensität) der Infektion(en)
- „S“ – die Häufigkeit (Summe) der Infektionen
- Störungen der Immunregulation sind bei primären Immundefekten häufig vorliegend und im Akronym „GARFIELD“ abgebildet: „G“ - kleinherdige, nicht nekrotisierende epitheloidzellige Granulome; „A“ – Autoimmunität, Autoinflammation, schwere Allergien; „RF“ – Rezidivierendes Fieber; „E“ – Ekzeme; „L“ – Lymphoproliferation (LK, Milz); „D“ – chronische Darmentzündung/Diarrhoe.
- Warnzeichen für primären Immundefekt sind:
- Pathologische Infektionsanfälligkeit „ELVIS“
- Immundysregulation „GARFIELD“ Autoinflammation sowie schwere Allergien
- Gedeihstörung bei Kindern, Gewichtsverlust bei Erwachsenen, meist mit Diarrhoe
- Syndromale Erkrankungen
- Auffällige Familienanamnese (Konsanguinität, Immundefekt, pathologische Infektionsanfälligkeit, Immundysregulation, Lymphome)
- Hypogammaglobulinämie, anhaltende oder rezidivierende Lymphozytopenie, Neutropenie, Thrombozytopenie
- Ein auffälliges Neugeborenen SCID-Screening
Bei mindestens einem dieser Warnzeichen sollte eine weitere Abklärung erfolgen - Die Basisdiagnostik bei Verdacht auf einen primären Immundefekt sollte ein Blutbild mit Differenzialblutbild und die Bestimmung der Immunglobuline (IgM, IgG, IgA, IgE) enthalten
- Die weiterführende Diagnostik (und ggf. Behandlung) soll in enger Zusammenarbeit mit einem spezialisierten Zentrum erfolgen.
HIV-Resistenztest aus proviraler DNA5
Die Resistenzbestimmung aus proviraler HIV-DNA ist eine aufwändige Reservemethode der genotypischen HIV-Resistenzbestimmung. Die Infectious Disease Society of America (IDSA) hat zum Einsatz und zur Interpretation dieser Methode eine Leitlinie vorgestellt3:
- Indikationen
- Wiederholt nicht erfolgreiche konventionelle RNA-basierte Genotyp. HIV-Resistenzbestimmung bei versagendem Regime, wegen z.B. (zu) niedriger Viruslast
- Bei geplantem erneuten Einsatz einer Komponente eines zuvor versagenden Regimes
- Wenn NNRTI-Resistenz vermutet wird bei unregelmäßiger Einnahme eines zuvor eingesetzten NNRTI-basierten Regimes
- Zur Bestimmung des HIV-Subtyps bei unterdrückter Viruslast
- Zur Bestimmung des Co-Rezeptor Tropismus (CXCR4 vs. CCR5)
- Bei Pat., die nach einem versagenden Regime eine Therapiepause hatten oder bei therapie-naiven Pat. mit (anamnestisch) hohem Risiko für Infektion mit einem resistenten Virusstamm (wg. zwischenzeitlichem Aufwachsen von replikations-freudigeren Stämmen mit anderem Resistenzmuster)
Kommentar
Die Ergebnisse müssen mit Vorsicht und in Zusammenschau mit der Behandlungshistorie interpretiert werden. Es gibt technische Probleme, keine prospektiven Studien zur Aussagekraft, Über- und Unterdiagnostik von Resistenzen kann auftreten. Bei den o.g. Fragestellungen sollten erfahrene HIV-Spezialisten konsultiert werden.
Candidiasis6
In der Wertung der Relevanz und Therapiebedürftigkeit des Nachweises von Candida bestehen oft große Unsicherheiten, und nicht selten wird reine Besiedelung unnötigerweise antimykotisch behandelt. Andererseits können Candida-Infektionen insbesondere bei immunkompromittierten Patienten lebensbedrohlich sein und die Behandlung invasiver Candida-Mykosen wird zunehmend durch Resistenzen der Pilze kompliziert. Die im Februar 2025 unter Leitung von O.A. Cornely (Köln) publizierte internationale Leitlinie zur Diagnose und Therapie der Candidiasis4 gibt hier Unterstützung.
- Diagnostik
- Bei V.a. systemische Candidose sollen 3 Paare Blutkulturen abgenommen werden. Zusätzlich wird eine mikroskopische Untersuchung der Gewebe- oder flüssigen Probe gefordert, um eine invasive Mykose (entzündliche Reaktion des Gewebes und Nachweis von Hyphen) von bloßer Besiedelung abgrenzen zu können.
- Die Candida-Spezies-Bestimmung sollte mittels MALDI-TOF erfolgen
- Therapie
- Candidämie: Echinocandine als first line Behandlung, evtl. step-down auf ein Azol (p.o.!) nach 5 Tagen, wenn:
- Hämodynamisch stabil
- Blutstrom frei von Candida
- Nicht neutropenisch
- Quelle (z.B. ZVK) entfernt
- Isolat S bzgl. dem gewählten Azol
- Pat. kann p.o. Medikamente einnehmen
- Die Behandlung von Candidämie erfordert mindestens 14 Tage Therapie, beginnend mit der letzten von 3 (drei !) konsekutiv negativen Blutkulturen
- Ein ggf. vorhandener ZVK soll gewechselt werden
- Spiegelkontrolle von Caspofungin und insbes. der Azole ist empfohlen
- Okuläre und ZNS-Candida-Infektionen: liposomales Amphotericin B +/- Flucytosin
- Candida-Endokarditis: Caspofungin oder liposomales Amphotericin B +/- Flucytosin für 12 Wochen, Klappen-OP, lebenslange Fluconazol-Suppressionstherapie erwägen
- für Patienten mit komplizierter abdomineller Chirurgie oder mit Neutropenie können Prophylaxen mit einem Azol (u.U. auch mit einem Echinocandin) erwogen werden
- Hygiene
- C. auris erfordert extrem aufwändige (und kostspielige!) Hygiene-Maßnahmen wegen dessen hoher Resistenz an der Umwelt
Kommentar
Neu in der Candida-Leitlinie sind die Forderung von 3 konsekutiv negativen Blutkulturen bei Candidämie und die Beurteilung von C. auris, der in Zukunft möglicherweise erhebliche Probleme machen wird.
Pulmonale Aspergillose bei Intensiv-Patienten7
Die pulmonale Aspergillose tritt typischerweise bei Patienten mit prolongierter Neutropenie, z.B. i.R. einer Chemotherapie oder Stammzelltransplantation oder bei Immunsuppression zur Verhinderung einer Abstoßungsreaktion bei Transplantation solider Organe auf. In letzter Zeit wurden pulmonale Aspergillosen jedoch auch bei kritisch kranken Patienten mit anderen Diagnosen beobachtet. Die Ende 2024 publizierte S1-Leitlinie der Deutschen Gesellschaft für internistische Intensiv- und Notfallmedizin Diagnose und Therapie der Pulmonalen Aspergillose bei Intensiv-Patienten (AWMF 113-005)7 ordnet dies ein.
- Risikopatienten sind:
- schwere Influenza- oder COVID-19- Infektionen und andere pulm. Infektionen mit Entwicklung eines ARDS
- schwere COPD
- dekompensierte Leberzirrhose, V.a. bei Alkoholabusus
- nicht behandelte HIV-Infektion (<200 CD4+ Zellen/ul)
- Organtransplantation mit entsprechender Abstoßungs-Prophylaxe, insbesondere Herz- und Lungentransplantation
- allogene Stammzelltransplantation mit entspr. GVHD-Prophylaxe
- langdauernde/hochdosierte Corticosteroid-Therapie
- Kolonisation mit Aspergillus spp., z.B. durch Umweltexposition (Erde, Staub)
- Wegweisende Symptome
- trotz adäquater antibiot. Therapie/Fokuskontrolle >72h persist. Fieber ≥38,3°C
- unter antibiot. Therapie nach >48h neu aufgetretenes Fieber ohne andere Ursache
- Hämoptysen und andere pulm. Symptome
- respiratorische Verschlechterung trotz adäquater Antibiotikatherapie und Beatmungsunterstützung
- Diagnostik
- Bronchoskopie mit Inspektion, Lavage und mikrobiologischen Proben
- Aspergillus-Kultur und Galactomannan aus Lavage (ß-D-Glucan nicht empfohlen)
- Evtl. Galactomannan aus Serum
- CT-Thorax (mit KM bei Hämoptysen)
- Beurteilung
- bestätigte invasive Aspergillose:
- Lunge: Histologischer Nachweis der Gewebsinvasion + pos. Aspergillus-Kultur
- Pos. Aspergillus-Kultur aus invasiv gewonnener Probe aus einer üblicherweise sterilen Körperregion
- mögliche invasive pulmonale oder tracheobronchiale Aspergillose:
- typischer bronchoskopischer Befund (Ulzerationen, Membranen) und/oder typischer radiolog. Befund + pos. Aspergillus-Kultur und/oder pos. Galaktomannan-Test.
- Therapie
- Indikation bei bestätigter invasiver Aspergillose oder möglicher invasiver pulmonaler/tracheo-bronchialer Aspergillose
- first line: Voriconazol, Isavuconazol (Interaktionen beachten! Spiegelkontrollen!)
- second line: liposomales Amphotericin B
- salvage/add on: Caspofungin
Kommentar
Die Leitlinie beschreibt die diagnostischen und therapeutischen Probleme dieser schweren infektiösen Komplikation bei diesen in der Regel kritisch kranken Patienten, die beschriebenen Verfahren werden aber in der Regel bereits i.S. von „good clinical practice“ so angewendet.
Komplizierter Harnwegsinfekt8
 © Adobe Stock
© Adobe Stock
Es gibt verschiedene nationale und internationale Leitlinien zur Diagnostik und Therapie des unkomplizierten Harnwegsinfekts (HWI), der komplizierte HWI blieb jedoch bisher weitgehend ausgespart. Die Infectious Disease Society of America (IDSA) hat am 17.07.2025 eine neue Leitlinie für den komplizierten Harnwegsinfekt vorgestellt, zunächst nur in Kurzfassung, und gleich eine neue Definition dafür eingeführt.
Die wesentlichen Aussagen der LL sind:
- Definition
- Unkomplizierter HWI: Infektion bei fieberfreiem Pat. (Frau oder Mann (!) ), auf die Harnblase beschränkt
- Komplizierter HWI: Pyelonephritis, mit Fieber und/oder Bakteriämie, ggf. Katheter-assoziiert; Prostatitis (nicht in der LL behandelt)
- Diagnostik
- Die IDSA-LL geht darauf nicht ein (Urin- und Blutkulturen sind selbstverständlich)
- Therapie
- 4-Schritt-Evaluation:
- Schweregrad der Erkrankung? (mit/ohne Sepsis)
- Risikofaktoren f. resistente Erreger (Vermeidung von Antibiotika, gegen die Isolate bei vorangegangenen HWI-Episoden resistent waren; spezifisch: Vermeidung von Fluorchinolonen, wenn diese innerhalb der letzten 12 Monate gegeben worden waren)
- Patientenfaktoren (Allergien, Medikations-Interaktionen, Fähigkeit orale Med. einzunehmen)
- Anpassung nach Antibiogramm (ggf. Deeskalation)
- je nach Ergebnis der Evaluation:
- empirisch für kompliz. HWI mit Sepsis: Dritt- oder Viertgenerations-Cefalosporin, Piperacillin-Tazobactam, Carbapenem oder Fluorchinolon
- empirisch für kompliz. HWI ohne Sepsis: Dritt- oder Viertgenerations-Cefalosporin, Piperacillin-Tazobactam oder Fluorchinolon. Carbapeneme vermeiden.
- bei Patienten, die eine Besserung erfahren, orale Medikation einnehmen können und das Isolat auf ein adäquates Antibiotikum empfindlich ist, sobald als möglich Umstellung auf orale Therapie (bevorzugt Cotrimoxazol oder ein Fluorchinolon, evtl. orale Cefalosporine oder Amoxiclav), auch wenn Bakteriämie vorgelegen hat (!) .
- Therapiedauer 5-7 Tage (bei Prostatitis beim Mann länger)
Kommentar
Die bisher nur als Kurzzusammenfassung auf der IDSA-Homepage veröffentlichte LL ist pragmatisch und legt bei der Häufigkeit von HWI Wert auf Antimicrobial Stewardship, vor dem Hintergrund, dass die Letalität von komplizierten HWI ohne begleitende Sepsis ausgesprochen niedrig ist. Neu ist die Definition, vor allem, dass auch der HWI beim Mann, wenn reine Zystitis, nicht mehr als kompliziert bezeichnet wird. Allerdings ist eine Prostatitis beim Mann bei HWI nicht selten, und dann damit doch ein komplizierter HWI.
Ambulant erworbene Pneumonie9
Die American Thoracic Society hat im Mai 2025 ein Update zur 2019 veröffentlichten Leitlinie zur Diagnostik und Therapie der ambulant erworbenen Pneumonie herausgegeben. Diese umfasst folgende Empfehlungen:
- Die Thorax-Sonographie ist eine akzepable Alternative zum Röntgen-Thorax für die Diagnose einer ambulant erworbenen Pneumonie
- Nicht hospitalisierte Patienten ohne Begleiterkrankungen und mit durch Bildgebung diagnostizierter ambulant erworbener Pneumonie und positivem Virus-Nachweis (z.B. Influenza, SARS-CoV-2, RSV, etc.) sollen keine antibiotische Therapie erhalten
- Nicht hospitalisierte Patienten mit Begleiterkrankungen und mit durch Bildgebung diagnostizierter ambulant erworbener Pneumonie und positivem Virus-Nachweis sollen antibiotisch behandelt werden (wg. möglicher bakterieller Co-Infektion)
- Hospitalisierte Patienten mit durch Bildgebung diagnostizierter ambulant erworbener Pneumonie (jeglichen Schweregrades) und positivem Virus-Nachweis sollen antibiotisch behandelt werden
- Empfohlene Behandlungsdauer:
- für ambulante Behandlung: mindestens 3, aber weniger als 5 Tage
- für stationäre Behandlung einer nicht schweren ambulant erworbenen Pneumonie und klinischer Stabilisierung: mindestens 3, aber weniger als 5 Tage
- für stationäre Behandlung einer schweren ambulant erworbenen Pneumonie mindestens 5 Tage oder länger
- Corticosteroide nur bei stationärer Behandlung und schwerer Pneumonie
Kommentar
Die ATS-Leitlinie hat nur die o.g. Aspekte zum Inhalt und ist damit weit weniger detailliert als z.B. die deutsche S3-Leitlinie von 2021. Einen breiten Raum in der Entscheidung einnehmender Aspekt ist der Nachweis von respiratorischen Viren, der – zumindest im ambulanten Bereich – in Deutschland sicher nicht regelmäßig breit durchgeführt wird. Der zweite wichtige Aspekt ist die (nochmalige) Verkürzung der Therapie auf 3-5 Tage für nicht schwere Pneumonien. Steroide sind nur bei schweren Verläufen einzusetzen. Es bleibt abzuwarten, wie die für 2027 erwartete Neuauflage der deutschen LL zur ambulant erworbenen Pneumonie zu diesen Themen Stellung nimmt.
1 https://register.awmf.org/assets/guidelines/067-009l_S3_PAP_2025-02.pdf
2 DeSimone DC, et al. Blood Culture–Negative Endocarditis: A Scientific Statement From the American Heart Association. J Am Heart Assoc. 2025;14:e040218. DOI: 10.1161/JAHA.124.040218
3 https://register.awmf.org/de/leitlinien/detail/079-001
4 https://register.awmf.org/de/leitlinien/detail/189-003
5 Wensing AM, et al. Utilizing HIV Proviral DNA to Assess for the Presence of HIV Drug Resistance. Clin Infect Dis. 2025 Apr 3:ciaf161. doi: 10.1093/cid/ciaf161.
6 Cornely OA, et al. Global guideline for the diagnosis and management of candidiasis: an initiative of the ECMM in cooperation with ISHAM and ASM. Lancet Infect Dis 2025;25:e280–93
7 https://register.awmf.org/de/leitlinien/detail/113-005
8 Trautner BW et al. Complicated urinary tract infections (cUTI): Clinical guidelines for treatment and management. https://www.idsociety.org/practice-guideline/complicated-urinary-tract-infections/
9 Jones BE et al. Diagnosis and management of community-acquired pneumonia: An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med 2025. DOI: 10.1164/rccm.202507-1692ST








 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen