Silke M. Besier und Volkhard A. J. Kempf, Frankfurt
Bartonellen-Infektionen Häufig, aber häufig verkannt
In Deutschland werden die meisten Bartonellosen beim Menschen durch B. henselae und B. quintana verursacht, die übrigen 13 gegenwärtig als humanpathogen geltenden Spezies dürften nur eine deutlich geringere klinische Rolle spielen.
Bartonella henselae ist weltweit verbreitet und wird typischerweise durch Biss- oder Kratzwunden von jungen (symptomlosen) Katzen auf den Menschen übertragen. Ca. 13% der Hauskatzen in Deutschland sind bakteriämisch, bei streunenden oder in Tierheimen untergebrachten Katzen liegt der Anteil zwischen bei 16-89%. Übertragungen von Mensch-zu-Mensch kommen nicht vor, familiäre Häufungen sind wahrscheinlich durch Kontakt mit demselben Tier bedingt. Die KKK wird in Deutschland selten diagnostiziert, obwohl die Seroprävalenz von anti-B. henselae IgG bei etwa 10% liegt und rund 14% aller Lymphadenopathien im Kopf-Hals-Bereich durch den Erreger verursacht werden. Die Inkubationszeit beträgt ca. 3-10 Tage bis zum Auftreten der Hautläsion und weitere 2-6 Wochen bis zur Entstehung einer Lymphadenitis.

Tab. 1 Erkrankungsbilder und Erreger
Bartonella quintana ist ebenfalls weltweit endemisch, der Mensch galt bisher als das einzige Reservoir, möglicherweise können auch Hunde infiziert sein. Eine Übertragung erfolgt durch den Kot von Kleiderläusen. Infektionen sind an schlechte sanitäre und unhygienische Lebensbedingungen geknüpft und waren während des 1. Weltkriegs unter Soldaten weit verbreitet. B. quintana gewinnt zunehmende Bedeutung als Erreger von Bakteriämien und Endokarditiden bei HIV-infizierten Patienten und Obdachlosen, die aufgrund des häufigen Befalls mit Körperläusen (Vektor) vom sog. „urban trench-fever“ bedroht sind. Endemische Foci bestehen noch in Russland, Mexiko, Bolivien, Nordafrika, Burundi und Äthiopien. Die Inkubationszeit beträgt 3 Tage bis 5 Wochen. Aktuelle Kriegsaktivitäten lassen befürchten, dass das Schützengrabenfieber wieder häufiger vorkommen wird.
Bartonella bacilliformis und Bartonella ancashensis: verursachen das sog. Oroyafieber. Das Verbreitungsgebiet des Erregers ist Südamerika, hier v.a. die Hochtäler der Anden (Peru, Kolumbien, Ecuador, Bolivien, Chile). Asymptomatische bakteriämische Patienten stellen das Erregerreservoir dar. Ein Drittel der gesunden Bevölkerung aus den Endemiegebieten Perus besitzt Antikörper gegen B. bacilliformis. Sandmücken der Gattung Lutzomyia, die in den Andentälern in Höhen zwischen ca. 500 und 3.000 m vorkommen, übertragen B. bacilliformis durch Aufnahme infektiösen Blutes asymptomatischer Patienten. Die Inkubationszeit der biphasischen Erkrankung beträgt etwa 3 Wochen.
Katzenkratzkrankheit
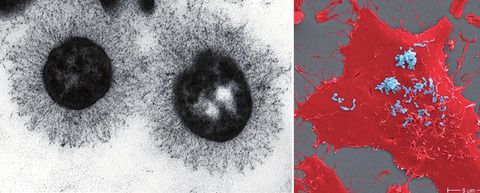
Abb. 1 Links: Bartonella henselaemit Expression des langen trimeren Autotransporteradhäsins BadA Entnommen aus: Kaiser et al., 2011. Rechts: Mit B. henselae(blau) infizierte Endothelzellen (rot, Rasterelektronenmikroskopie). Entnommen aus: van Belkum et al., 2021
B. henselae (selten B. clarridgeiae) ist der Erreger der Katzenkratzkrankheit (KKK) sowie einer „kulturnegativen“ Endokarditis. Der Erreger verursacht bei Immunsupprimierten (z.B. AIDS-Patienten) die vaskuloproliferativen Erkrankungen bazilläre Angiomatose und Peliosis hepatis.
Von der KKK sind vor allem Kinder und Jugendliche (überwiegend zwischen September und Februar) betroffen. Nach Infektion (Katzenkratzer, -bisse) entsteht nach wenigen Tagen eine nicht juckende Hauteffloreszenz, von der die Erreger in die regionalen Lymphknoten (v.a. axillär oder zervikal) drainiert werden. Dort tritt nach Tagen bis Wochen eine ausgeprägte Lymphadenitis auf, die durch ein „Parinaud‘sches okuloglanduläres Syndrom“ (Symptomenkomplex von Lymphadenitis und nichteitriger Konjunktivitis) kompliziert werden kann. Kinder leiden zusätzlich häufig unter Übelkeit, auch Fieber, Kopf- und Gliederschmerzen, Arthralgien, Exantheme oder Thrombopenien kommen vor. Intermittierende Fieberschübe und rezidivierende, oft heftige Bauchschmerzen können auf einen Befall von Leber und Milz (mit oftmals sonografisch sichtbaren Mikroabszessen) hinweisen. Bei immunsupprimierten Patienten können die Erreger disseminieren. Selten kommt es zu neurologischen Komplikationen wie Enzephalitis und Neuroretinitis. Der Erreger wird mit vielen anderen Erkrankungen in Verbindung gebracht, die wissenschaftliche Evidenz hierfür ist oftmals umstritten. Es gibt keinerlei Beleg, dass „Striae“ (Hautdehnungsstreifen) durch B. henselae-Infektionen hervorgerufen werden können.

Das in Peru endemische Oroya-Fieber erreichte während des Baus der Eisenbahnstrecke von Lima in das 5.000 m hoch gelegene Minengebiet La Oroya Ende des 19. Jahrhunderts traurige Berühmtheit: Etwa 8.000 Menschen starben an „Oroya-Fieber“. Der Name eines Viadukts („Puente de Verrugas“) dieser Bahnstrecke erinnert noch heute an die Toten; man sagt, jede Schwelle dieser Eisenbahnstrecke habe ein Menschenleben gekostet. Hier ein Bild des Autors des Beitrags zusammen mit dem Projekt betrauten Mitarbeiter Dr. Alexander Dichter am Viadukt „Puente de Verrugas“ an der Bahnstrecke Lima – La Rocha im Rahmen einer Feld-Studie (Peru, November 2022)
Die KKK heilt zumeist unbehandelt innerhalb von 6–12 Wochen spontan ab, weswegen in der Regel weder eine chirurgische Intervention noch antibakterielle Therapie notwendig wird. Bei prolongierter oder disseminierter Infektion, Organbefall oder der bazillären Angiomatose/Peliosis wird eine Therapie mittels intrazellulär wirksamer Antibiotika wie Azithromycin (alternativ: Clarithromycin oder Doxycyclin) evtl. in Kombination mit Rifampicin für 5 Tage (bis Monate) empfohlen. Rückfälle bei immunsupprimierten Patienten sind häufig. Immunsupprimierte und HIV-infizierte Patienten sollten den Kontakt zu Katzen meiden. Eine Prophylaxe gegen nicht-tuberkulöse Mykobakterien bei HIV-infizierten Patienten schützt vor einer Erkrankung mit Bartonella spp..
Vaskuloproliferative Krankheitsbilder
Bartonellen besitzen die einzigartige Fähigkeit, beim Menschen pathologisches Blutgefäßwachstum auszulösen. An den vaskuloproliferativen Krankheitsbildern Bazilläre Angiomatose (kutan) oder Peliosis hepatis (hepatisch) leiden in erster Linie insbesondere HIV Patienten mit niedrigen CD4-Zellzahlen im AIDS Stadium der Erkrankung, die durch das Auftreten starker Blutungen aus diesen Gefäßkonvoluten gefährdet sind. Die Therapie besteht aus der Gabe von Erythromycin über mindestens 2 Monate, in der Regel kommt es darunter zu einer vollständigen Rückbildung der Läsionen. Rezidive sind häufig, so lange es nicht gelingt die Grunderkrankung erfolgreich zu behandeln.
Schützengrabenfieber
B.
quintana
verursacht das sog. Schützengrabenfieber (Wolhynisches Fieber,
Fünftagefieber, trench
fever).
Nach einer Inkubationszeit von 1-3 Wochen beginnt die Krankheit
plötzlich mit Fieberschüben von jeweils etwa 5 Tagen Dauer, die von
Schüttelfrost, Arthralgien und Kopfschmerzen begleitet werden. Die
Erkrankung kann über Monate persistieren und heilt in der Regel
spontan aus. Das Korrelat der charakteristischen prätibialen
Schmerzen sind osteolytische Läsionen. Heute spielt B.
quintana
eine klinische Rolle als Auslöser von fieberhaften Bakteriämien und
Endokarditiden v.a. bei
Obdachlosen. Unkomplizierte
Erkrankungen können mit Doxycyclin behandelt werden. Bei chronisch
bakteriämischen Erkrankungen und bei Endokarditis ist eine
Kombinationstherapie (Doxycyclin und Gentamicin) angezeigt.
„Kulturnegative“ Endokarditis

Das Leistungsangebot des Konsiliarlabors für Bartonellen umfasst den
konventionellen und molekulargenetischen Erregernachweis mittels serologischer Untersuchungsmethoden
(Antikörpernachweis mittels Immunfluoreszenztest). Für die infektionsserologische Untersuchung wird Serum als Probenmaterial verwendet
und für den molekularbiologischen
Nachweis vorzugsweise EDTA-Blut,
Biopsate, Punktate, Liquor.
Hinweis:
Einsendung von Material nur nach
vorheriger Absprache.
Konsiliarlaboratorium für Bartonellen
Paul-Ehrlich-Str. 40
D-60596 Frankfurt am Main
Telefon: +49 69 6301 - 5019
Fax: +49 69 6301 - 83431
E-Mail: volkhard.kempf@kgu.de
whttps://www.unimedizin-ffm.de/
einrichtungen/institute/zentrumder-hygiene/medizinische-mikrobiologie-und-krankenhaushygiene
Bartonella spp. sind für bis zu 3% der Endokarditiden verantwortlich, fast immer sind B. henselae oder B. quintana ursächlich. B. henselae-Endokarditis Fälle werden primär bei Patienten mit vorbestehenden Herzklappenerkrankungen und Kontakt zu Katzen beobachtet, an B. quintana-Endokarditiden leiden v.a. sozial deprivierte, obdachlose Patienten. Die Therapie besteht in einer prolongierten Antibiose mit Gentamicin, Ceftriaxon und ggf. Doxycyclin.
Carrión-Krankheit
Die Carrión-Krankheit wird durch B. bacilliformis verursacht und verläuft in zwei Phasen. Das Oroya-Fieber stellt das akute Stadium der Erkrankung dar: Nach ca. 3 Wochen Inkubationszeit treten zunächst starkes Krankheitsgefühl, hohes Fieber, Schüttelfrost, Kopf- und Gelenkschmerzen auf. Die ausgeprägte hämolytische Anämie wird durch den massiven Befall der Erythrozyten mit B. bacilliformis verursacht, unbehandelt liegt die Letalität bei 40-90%. Antibiotika der Wahl sind Ciprofloxacin, Chloramphenicol, Tetracyclin oder Erythromycin. Bei rechtzeitigem Einsatz führt eine Therapie zu schnellem Fieberabfall, trotz Behandlung beträgt die Letalität noch ca. 8%. Ein bis mehrere Monate nach dem akuten Stadium treten kutan lokalisierte hämangiomähnliche Hautveränderungen (Verruga peruana) auf, die sich an Extremitäten und Schleimhäuten finden. Die Läsionen sind schmerzlos, bluten leicht, persistieren über 3-4 Monate und heilen meist spontan ab. Zur Behandlung der Verruga peruana werden Streptomycin, Rifampicin oder Tetracyclin eingesetzt. Schutz vor Mückenstichen (Schutzkleidung, Repellents) sowie die Bekämpfung der Sandmücken sind geeignete Präventionsmöglichkeiten.
Nagetier-assoziierte Bartonellen
Insgesamt 23 bestätigte Infektionen des Menschen mit Nagetier-assoziierten Bartonellen wurden berichtet (Bartonella vinsonii subsp. arupensis, B. elizabethae, B. alsatica, B. tribocorum, B. vinsonii subsp. vinsonii, B. doshiae, B. grahamii und B. rattimassiliensis). Zwölf dieser Patienten litten an einer akuten fieberhaften Erkrankung, drei Patienten an Endokarditis, drei Patienten an Lymphadenopathie, zwei an unspezifischen Symptomen und jeweils ein Patient an bazillärer Angiomatose, hepatischen Läsionen oder Neuroretinitis (Übersicht in: Krügel et al., 2022). Zwei dieser Patienten waren immungeschwächt (HIV-Infektion, Leukämie). Das eingesetzte Antibiotikatherapieregime umfasste häufig die Verabreichung eines Makrolids in Kombination mit Doxycyclin über mehrere Wochen (Krügel et al., 2022). Infektionen mit Nagetier-assoziierten Bartonellen werden sehr selten diagnostiziert, vermutlich weil (i) Ärzte sich der Existenz von (Nagetier-assoziierten) Bartonella-Infektionen nicht bewusst sind, (ii) nur unspezifische Symptome bei den Patienten vorliegen, (iii) Labore die anspruchsvollen Erreger nicht nachweisen können, oder (iv) Infektionen mit Nagetier-assoziierten Bartonella-Arten tatsächlich selten sind.
Labordiagnostik
Die am besten geeigneten Verfahren zur Diagnose von B. henselae- oder B. quintana Infektionen sind Immunfluoreszenztests (IFT) zum serologischen Nachweis spezifischer Antikörper. Ein direkter Erregernachweis (in der Regel PCR-basiert) sollte immer dann angestrebt werden, wenn die Serologie nicht zu einer eindeutigen Diagnose führt oder wegen Immunsuppression unzuverlässig erscheint.
Stellungnahme:
„2023 ESC-Guidelines for the management of endocarditis“
Das Konsiliarlabor erreichen wiederholt Anfragen zu folgender Thematik: In der Publikation „2023 ESC Guidelines for the management of endocarditis“ (Delgado et al., 2023) ist zur Diagnostik einer Bartonella-Endokarditis in Tabelle 9 geschrieben: „Investigation of rare causes of blood culture negative endocarditis“: Bartonella spp. Serology (IgG phase I >1:800), blood cultures, tissue culture, immunohistology, and 16S rRNA sequencing of tissue”. Diese Angaben sind falsch: (i) Es existiert kein Phase I IgG in Bartonella-Infektionen, (ii) eine Serumverdünnung von 1:800 wird in keinem der dem Konsiliarlabor bekannten Testverfahren eingesetzt (die nächsten wären: 1:512/1.024 oder 1:640/1.280), (iii) kommerziell verfügbare Antikörper für Immunhistologie sind dem Konsiliarlabor nicht bekannt und (iv) neben der 16S-rDNA-Sequenzierung sind zahlreiche andere PCR-Verfahren etabliert. Eine Korrektur dieser Angaben durch die Autoren erscheint notwendig.
Nach derzeitigem Kenntnisstand sind folgende Untersuchungen mangels Evidenz abzulehnen: (i) Westernblots (kein definiertes Bandenmuster im Westernblot), (ii) Lymphozytentransformationstests (keine definierten Antigene), (iii) Infektionsnachweis über zirkulierende Serum-VEGF-Level (keinerlei Evaluationsdaten), (iv) mikroskopischer Nachweis einer veränderten Erythrozytenmorphologie mittels Dunkelfeldmikroskopie (keinerlei infektionsbiologische Grundlage).
Serologie
Die
wichtigsten Nachweisverfahren für B.
henselae oder B.
quintana Infektionen sind
infektionsserologische Untersuchungen. Die Prävalenz von
Antikörpern liegt (je nach cut
off-Wert) bei gesunden
Erwachsenen bei ≈7-30% und bei Kindern bei 3,5-13%. Der
Nachweis von spezifischen IgG-Antikörpern ist gut etabliert und
oftmals hilfreich, der Nachweis von IgM-Antikörpern wegen der
langen Inkubationszeiten von Bartonella-Infektionen
seltener wegweisend. IgG-Titer von ≥256 (oder ≥320) im
Immunfluoreszenztest deuten auf eine vorliegende oder überstandene
Infektion hin, als negativ gelten Titer von <64 (oder <80).
Dazwischenliegende IgG-Titer sind oftmals schwierig zu
interpretieren und können auch das Resultat verschiedener
unspezifischer Kreuzreaktionen (z.B. mit Mycoplasma
pneumoniae-Antikörpern) sein.
„Kulturnegative“ Endokarditiden sind
meistens durch sehr
hohe Titer charakterisiert. Zur Zeit sind lediglich für B.
henselae und B.
quintana kommerzielle
serologische Teste erhältlich.
Molekularer Nachweis
Der direkte Erregernachweis aus Biopsaten gilt als Goldstandard und sollte dann zum Einsatz kommen, wenn z.B. serologische Untersuchungen nicht zu einer eindeutigen Diagnose führen. Die Notwendigkeit einer invasiven Materialgewinnung stellt einen deutlichen Nachteil dar und schränkt den Einsatz in der Praxis ein. Der Nachweis Bartonella-spezifischer DNA mittels PCR und die nachfolgende Sequenzierung der Amplifikate ist zur Zeit die zuverlässigste Methode. Verschiedene PCR-Verfahren und Zielstrukturen sind im Einsatz. Der Nachweis erregerspezifischer DNA aus Herzklappen sollte der Standard sein.
Mikroskopie
Infektionen mit Bartonella schoenbuchensis durch Hirschlausfliegen?
Immer wieder wird in der Laienpresse über vermeintliche Infektionen des Menschen mit Bartonella schoenbuchensis (angeblich durch Hirschlausfliegen übertragen) berichtet. Dabei wird vor der „fliegenden Zecke“ und der durch einer B. schoenbuchensis-Infektion mit „tödlicher Herzentzündung“ gewarnt. Für diese Behauptungen existiert keinerlei Evidenz. Eigene Untersuchungen ergaben eine Prävalenz von ca. 70% von B. schoenbuchensis – DNA in Hirschlausfliegen (Regier et al., 2018), jedoch existiert in der internationalen Literatur kein einziger Fallbericht, der eine Übertragung dieses Erregers auf einen Patienten nahelegt. Lediglich ein vage beschriebener Fall einer Infektion mit B. schoenbuchensis (nach vorheriger, kausal unklarer Zeckenexposition) mit unspezifischen Symptomen (Fatigue, Muskelschmerzen, Fieber) wurde beschrieben (Vayssier-Taussat et al., 2016). Weder ist eine spezifische serologische Diagnostik noch eine evidenzbasierte Therapieempfehlung verfügbar.
In der histologischen Diagnostik kommt (je nach Verfügbarkeit) die Warthin-Starry-Färbung (Versilberungstechnik) zum Einsatz (Haut- oder Gewebebiopsate). Diese Färbung ist nicht spezifisch für Bartonellen, darüber hinaus erfordert die Beurteilung größte Erfahrung seitens des Untersuchers. Antikörper zum spezifischen Nachweis der Bakterien (Immunhistologie, Immunfluoreszenz) sind kommerziell nicht verfügbar. B. quintana- und B. bacilliformis-Infektionen können mikroskopisch (z.B. durch Färbung nach Giemsa) anhand der in den Erythrozyten erkennbaren Erreger aus Blutausstrichen diagnostiziert werden.
Kultur
Bei KKK besteht nur eine sehr geringe, bei vaskuloproliferativen und bakteriämischen Krankheitsbildern hingegen eine realistische Erfolgsaussicht zur Anzucht von Bartonella spp. Die meisten Bartonella spp. benötigen bis zu vier Monaten, bis dass ein Erreger-Wachstum verzeichnet werden kann, allein deshalb wird die Erstanzucht in den meisten Routinelaboratorien nicht gelingen. Die Kultur von B. quintana in Blutkultur-Flaschen (z.B. bei Vorliegen einer Endokarditis) gelingt manchmal. Neu beschriebene Flüssigmedien lassen erwarten, dass die Anzucht der Erreger in Zukunft häufiger möglich sein wird. Die Testung der Antibiotika-Empfindlichkeit von Bartonellen hat keinen Einzug in die Routinediagnostik gefunden.
Bewertung der Befunde
Der direkte Erregernachweis mittels Kultur oder molekulargenetischer Methoden beweist eine Infektion mit Bartonella spp. Hohe Antikörper-Titer bei Vorliegen einer Lymphadenitis oder Endokarditis sind ebenfalls wegweisend. Die Interpretation leicht erhöhter Antikörper-Titer bei unklaren Lymphknotenschwellungen ist schwierig und muss unter Einschluss der klinisch und anamnestisch vorliegenden Daten interpretiert werden. In serologisch unklaren Fällen sind Folgeuntersuchungen (Titerverlauf) zu empfehlen.
Literatur
Besier S, Kempf VAJ. Bartonellen. In: Suerbaum: Medizinische Mikrobiologie (Lehrbuch), Springer-Verlag 2020. ISBN : 978-3-662-61384-9.
Delgado V, Ajmone Marsan N, de Waha S, Bonaros N, Brida M, Burri H, Caselli S, Doenst T, Ederhy S, Erba PA, Foldager D, Fosbøl EL, Kovac J, Mestres CA, Miller OI, Miro JM, Pazdernik M, Pizzi MN, Quintana E, Rasmussen TB, Ristić AD, Rodés-Cabau J, Sionis A, Zühlke LJ, Borger MA; ESC Scientific Document Group. 2023 ESC Guidelines for the management of endocarditis. Eur Heart J. 2023 Oct 14;44(39):3948-4042. doi: 10.1093/eurheartj/ehad193.
Dichter AA, Schultze TG, Wenigmann A, Ballhorn W, Latz A, Ventosilla Lopez P, Guerra Allison H, Ugarte CA, Tsukayama P, Kempf VAJ. Identification of immunodominant Bartonella bacilliformis proteins: a combined in silico and serology approach. Lancet Microbe 2021; 2(12) 685 694.
Fischer SF, Al Dahouk S, Brandt C, Donoso-Mantke O, Frangoulidis D, Hofmann J, Jansen A, Krüger DH, Kimmig P, Kurth A, Niedrig M, Nitsche A, Nöckler K, Roggendorf M, Roß RS, Schacht E, Mayer-Scholl A, Scholz HC, Splettstoesser WD, Stark K, Wagner-Wiening C, Zöller L, Kempf VAJ (editor). MiQ 33: Zoonosen. Urban & Fischer, 2013. ISBN: 9783437415944.
Garcia-Quintanilla M, Dichter, AA, Guerra Allison H, Kempf VAJ. Carrion´s disease: more than a neglected disease. Parasites & Vectors, 2019, 26;12(1):141.
Kaiser PO, Riess T, O‘Rourke F, Linke D, Kempf VA. Bartonella spp.: throwing light on uncommon human infections. Int J Med Microbiol. 2011 Jan;301(1):7-15. doi: 10.1016/j.ijmm.2010.06.004.
Krügel
M, Król N, Kempf VAJ, Pfeffer M, Obiegala
A.
Emerging rodent-associated Bartonella:
a threat for
human health? Parasit Vectors. 2022 Mar 31; 15(1):113. doi:
10.1186/s13071-022-05162-5.
Nadal D, Kempf VAJ. Lutz E, Oehme A. Bartonellosen. Handbuch der Deutschen Gesellschaft für pädiatrische Infektiologie e.V., Thieme-Verlag, 2018. ISBN: 9783132407909.
Regier Y, Komma K, Weigel M, Pulliainen AT, Göttig S, Hain T, Kempf VAJ. Microbiome Analysis Reveals the Presence of Bartonella spp. and Acinetobacter spp. in Deer Keds (Lipoptena cervi). Front Microbiol. 2018 Dec 20;9:3100. doi: 10.3389/fmicb.2018.03100.
Vaca DJ van Belkum A, Orenga S, von Loewenich S, Fischer SF, Konrad M, Sapre SU, Keller C, Dobler G, Kempf VAJ. Contemporary diagnostics for medically relevant fastidious microorganisms belonging to the genera Anaplasma, Bartonella, Coxiella, Orientia and Rickettsia. FEMS Microbiol Rev., 2022 doi: 10.1093/femsre/fuac013.
van Belkum A, Almeida C, Bardiaux B, Barrass SV, Butcher SJ, Çaykara T, Chowdhury S, Datar R, Eastwood I, Goldman A, Goyal M, Happonen L, Izadi-Pruneyre N, Jacobsen T, Johnson PH, Kempf VAJ, Kiessling A, Bueno JL, Malik A, Malmström J, Meuskens I, Milner PA, Nilges M, Pamme N, Peyman SA, Rodrigues LR, Rodriguez-Mateos P, Sande MG, Silva CJ, Stasiak AC, Stehle T, Thibau A, Vaca DJ, Linke D. Host-Pathogen Adhesion as the Basis of Innovative Diagnostics for Emerging Pathogens. Diagnostics (Basel). 2021 Jul 14;11(7):1259. doi: 10.3390/diagnostics11071259.
Vayssier-Taussat M, Moutailler S, Féménia F, Raymond P, Croce O, La Scola B, Fournier PE, Raoult D. Identification of Novel Zoonotic Activity of Bartonella spp., France. Emerg Infect Dis. 2016 Mar;22(3):457-62. doi: 10.3201/eid2203.150269.







 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen